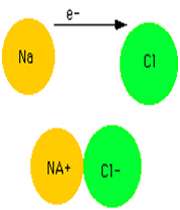
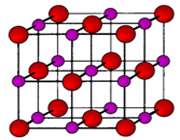
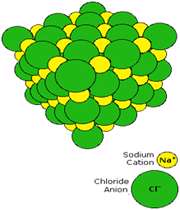
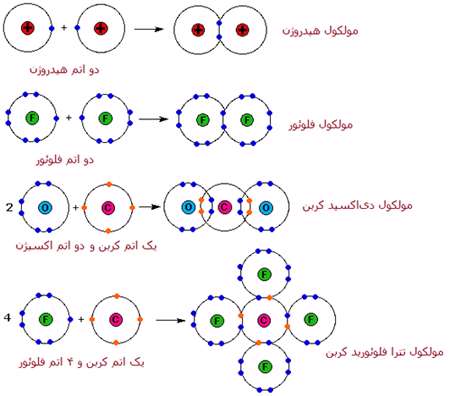
تبلیغات
تبلیغات متنی
محبوبترینها
ساقدوش کیست ؟ | وظیفه ساقدوش در مراسم عقد و عروسی چیست ؟
قایقسواری تالاب انزلی؛ تجربهای متفاوت با چاشنی تخفیف
چگونه ویزای توریستی فرانسه را بگیریم؟
معرفی و فروش بوته گرافیتی ریخته گری
بهترین بروکر برای معاملات فارکس در سال 2024
تجربه رانندگی با لندکروز در جزیره قشم؛ لوکسترین انتخاب
اکسپرتاپ: 10 شغل پردرآمد برای مهاجران کاری در کانادا
بهترین سایتهای خرید تیک آبی رسمی اینستاگرام در ایران
صفحه اول
آرشیو مطالب
ورود/عضویت
هواشناسی
قیمت طلا سکه و ارز
قیمت خودرو
مطالب در سایت شما
تبادل لینک
ارتباط با ما
مطالب سایت سرگرمی سبک زندگی سینما و تلویزیون فرهنگ و هنر پزشکی و سلامت اجتماع و خانواده تصویری دین و اندیشه ورزش اقتصادی سیاسی حوادث علم و فناوری سایتهای دانلود گوناگون
مطالب سایت سرگرمی سبک زندگی سینما و تلویزیون فرهنگ و هنر پزشکی و سلامت اجتماع و خانواده تصویری دین و اندیشه ورزش اقتصادی سیاسی حوادث علم و فناوری سایتهای دانلود گوناگون
آمار وبسایت
تعداد کل بازدیدها :
1815812051