
 واضح آرشیو وب فارسی:تبیان: قانون اول ترمودینامیک (2) قانون اول به ما اجازه میدهد که مقدار مجهول گرما یا کار لازم برای یک فرآیند را با استفاده از مقدار گرما و کار لازم برای فرآیندی متفاوت که سیستم را از همان حالت آغازین به حالت نهایی مشابه میرساند، محاسبه کنیم. همچنین گاه به کمک آن میتوانیم نتایج کیفی عمومی درباره ی رفتار یک سیستم به دست آوریم. برای مثال، آزمایش زیر را در نظر بگیرید.
واضح آرشیو وب فارسی:تبیان: قانون اول ترمودینامیک (2) قانون اول به ما اجازه میدهد که مقدار مجهول گرما یا کار لازم برای یک فرآیند را با استفاده از مقدار گرما و کار لازم برای فرآیندی متفاوت که سیستم را از همان حالت آغازین به حالت نهایی مشابه میرساند، محاسبه کنیم. همچنین گاه به کمک آن میتوانیم نتایج کیفی عمومی درباره ی رفتار یک سیستم به دست آوریم. برای مثال، آزمایش زیر را در نظر بگیرید.
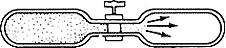
یک بطری را که از نظر حرارتی عایق بندی شده با گاز آرمانی در دمایی مانند T1 بردارید، و به وسیله ی یک لوله که شیری به آن متصل است ، آن را به بطری عایق بندی شده ی دیگری که خلاء شده است، متصل کنید. (شکل بالا) اگر ناگهان شیر را باز کنید، گاز از بطری اول به درون دومی نشست می کند تا فشارها برابر شوند. به طور تجربی، دریافته ایم که این فرآیند انبساط آزاد، دمای گاز را تغییر نمی دهد. هنگامی که گاز به تعادل دست مییابد و شارش متوقف می شود، دمای نهایی هر دو بطری، برابر با دمای آغازین(T1) است. از این مشاهده تجربی چه نتیجه ای می گیریم؟ از آن جا که بطری ها از نظر حرارتی از محیط پیرامونشان عایق بندی شده اند، فرآیند انبساط، نه گرمایی به گاز میافزاید و نه از آن میگیرد. یعنیQ=0 است. افزون بر این، فرآیند انبساط، متضمن کاری نیست ( به استثناء مقدار ناچیزی که برای چرخاندن شیر لازم است)، یعنیW=0 است. در نتیجه قانون اول به ما میگوید که انرژی گاز تغییر نمی کند. این نشان میدهد که تغییر حجم بر انرژی اثر نمی گذارد؛ یعنی، انرژی درونی گاز آرمانی، تابعی از حجم نیست. بنابر قانون اول، فرض شده است انرژی گاز، تابعی از پارامترهای ماکروسکوپی p،V و T است. از آن جا که قانون گاز آرمانی به ما اجازه میدهد که p را بر حسب V و T بیان کنیم، انرژی را میتوان به صورت تابعی از دو متغیر V و T انگاشت. ولی مطالب بالا نشان میدهد که تغییر حجم بر انرژی بی اثر است؛ در نتیجه، انرژی درونی گاز آرمانی فقط تابعی از دما است. نتایج ترمودینامیک، فقط برای حالت های تعادلی سیستم به کار میرود، یعنی آن حالت های ایستایی که هنگام انتقال جرم، انتقال حرارت، و همه ی واکنش های شیمیایی و اتمام دیگر واکنش ها،سیستم در آن آرام میگیرد. برای گاز درون دو بطری که در شکل نشان داده شده، حالت آغازین (گاز در یک بطری محدود شده و شیر بسته است) یک حالت تعادل است، و حالت نهایی (گاز به طور یکنواخت در هر دو بطری توزیع شده) نیز یک حالت تعادل است. اما حالت میانی، هنگامی که بلافاصله پس از این که شیر را باز میکنیم، و گاز از بطری پر به درون بطری خالی هجوم میبرد، یک حالت تعادل نیست. بنابراین مجبوریم در این مورد (و نیز در سایر مسائل ترمودینامیک) محاسبات را به تغییرات کند و گام به گام (شبه ایستا و نزدیک به حالت تعادل) محدود میکنیم تا فرمول ها در حین تغییر نیز، صادق باشند. ممکن است چنین محدودیتی دست و پا گیر به نظر برسد، اما در عمل خواهید دید که آن قدر هم که تصور میشود، دردسرساز نیست. با استفاده از مدل سازی زیر میتوانید مطالبی را که آموخته اید، تمرین کنید. برای مشاهده ی این مدلسازی به نرم افزار shockwave player نیاز دارید. برای دیدن مدل سازی لینک زیر را کلیک کنید و فایل مورد نظر را با internet explorer باز کنید. مدل سازی برای ساده تر کردن این مدل سازی مطالب زیر را فرض نموده ایم: گاز ایده آل است، پس دما، نشان دهنده ی میزان انرژی درونی آن میباشد. فشار اتمسفر در محاسبات منظور نشده است؛ یعنی فرض کرده ایم که آزمایش در خلاء انجام میشود. سطح مقطع پیستون دیسکی به قطر 4/67 سانتی متر است. تعداد مول های گاز3- 10*1/023 میباشد، که در این صورت مقدار گردشده nR برابر 0/01 ژول بر درجه کلوین خواهد بود. بازه ی تغییرات V,P و T محدود است. تغییرات دمایی بایستی در محدوده ی 2 تا 200 درجه کلوین صورت گیرد و حداکثر فشار مجاز نیز 200 کیلو پاسکال است. حداقل حجم ممکن هم 21cc است. این مقادیر به طور تقریبا اتفاقی انتخاب شده اند، اما نشان میدهند که حجم یا دما هیچ گاه نمی تواند صفر شود؟ آیا میتوانید دلیل این امر را توضیح دهید؟ ما قصد داریم تا در مطلب بعدی با هم به بررسی قانون دوم ترمودینامیک و نتایج آن بپردازیم.

این صفحه را در گوگل محبوب کنید
[ارسال شده از: تبیان]
[مشاهده در: www.tebyan.net]
[تعداد بازديد از اين مطلب: 382]
















